
Oral SMEDDS promotes lymphatic transport and mesenteric lymph nodes target of chlorogenic acid for effective T-cell antitumor immunity
這篇論文研究了口服自微乳化藥物遞送系統(SMEDDS)對綠原酸(CHA)的淋巴運輸和腸系膜淋巴結(MLNs)靶向輸送,以提高有效的T細胞抗腫瘤免疫。
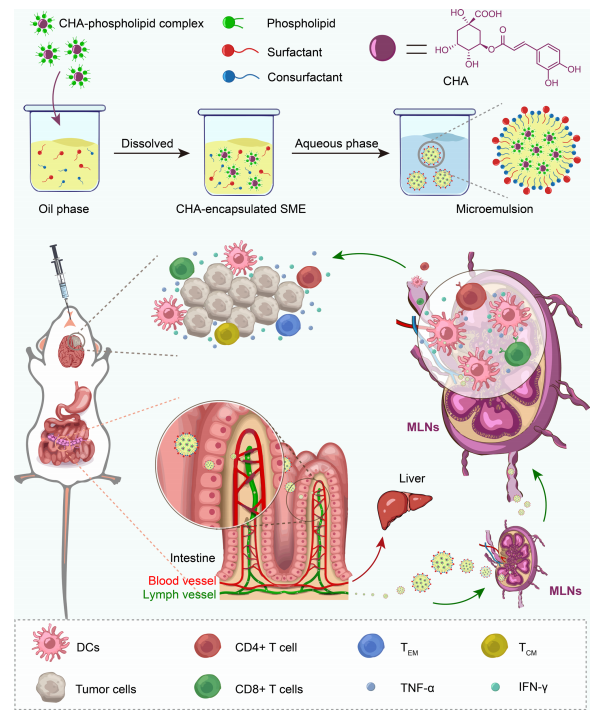
CHA-SME對免疫細胞的制備、腸道淋巴轉運和免疫調節作用的示意圖
研究背景
1、腸系膜淋巴結(MLNs)是免疫系統的重要淋巴節點,容納了體內超過一半的淋巴細胞,具有作為癌癥免疫治療靶點的潛力。
2、由于淋巴結的結構和解剖特點,傳統藥物遞送途徑難以有效到達淋巴結,且免疫調節劑的口服生物利用度低,淋巴積累有限。
3、自微乳化藥物遞送系統(SMEDDS)已被證明可以通過腸道淋巴運輸途徑提高藥物的口服生物利用度,但其在免疫調節劑向MLNs的高效遞送方面的研究較少。
研究方法
1、開發了CHA-封裝的SMEDDS(CHA-SME),通過溶劑蒸發法制備CHA-磷脂復合物,并將其與油相、表面活性劑和助表面活性劑混合,形成透明的微乳液。
2、使用Caco-2細胞和SD大鼠進行體外和體內實驗,評估CHA-SME的腸上皮細胞透過性、淋巴運輸能力和免疫調節效果。
3、通過動態光散射(DLS)、透射電子顯微鏡(TEM)和原子力顯微鏡(AFM)等方法對CHA-SME的粒徑、分布和zeta電位進行表征。
實驗設計
1、體外實驗:評估CHA-SME對Caco-2細胞和C6細胞的細胞毒性,使用CCK-8試劑盒測定細胞活力,并通過LDH釋放實驗評估細胞膜完整性。
2、細胞攝取實驗:使用共聚焦激光掃描顯微鏡(CLSM)和流式細胞術定量分析Cou-6標記的CHA-SME在Caco-2細胞中的攝取情況。
4、體內實驗:建立皮下和原位膠質瘤模型,評估CHA-SME的抗腫瘤效果和免疫調節作用。通過熒光成像和流式細胞術分析CHA-SME在腸道和MLNs中的分布情況。
結果與分析
1、CHA-SME顯著提高了CHA在腸道上皮細胞中的滲透性,并通過淋巴運輸途徑促進了藥物在MLNs中的積累。
2、在體外實驗中,CHA-SME對Caco-2細胞和C6細胞的細胞毒性較低,細胞活力在CHA濃度為0.01-100 µM時接近100%。
3、在體內實驗中,CHA-SME顯著抑制了皮下和原位膠質瘤的生長,腫瘤生長抑制率(TGI%)顯著高于游離CHA組。
4、CHA-SME顯著促進了樹突狀細胞(DCs)的成熟和T細胞的活化,增加了腫瘤組織中浸潤的CD3+、CD4+和CD8+ T細胞的比例。
總體結論
1、CHA-SME通過淋巴運輸途徑高效地將CHA遞送到MLNs,促進了免疫細胞的活化和抗腫瘤免疫反應。
2、口服CHA-SME為膠質瘤的MLNs靶向癌癥免疫治療提供了一種潛在策略,能夠繞過免疫檢查點阻斷療法中的穿透性差和耐藥性問題。
3、該研究強調了通過促進藥物在MLNs中的積累來增強淋巴細胞接觸和抗腫瘤免疫活性的高效性。
這篇論文展示了CHA-SME在提高CHA的免疫治療效果方面的潛力,為癌癥免疫治療提供了新的思路。

