
Targeted delivery of chlorogenic acid by mannosylated liposomes to effectively promote the polarization of TAMs for the treatment of glioblastoma
這篇文章研究了通過甘露糖修飾的脂質體靶向遞送綠原酸(CHA),以有效促進腫瘤相關巨噬細胞(TAMs)的極化,從而治療膠質母細胞瘤(GBM)。
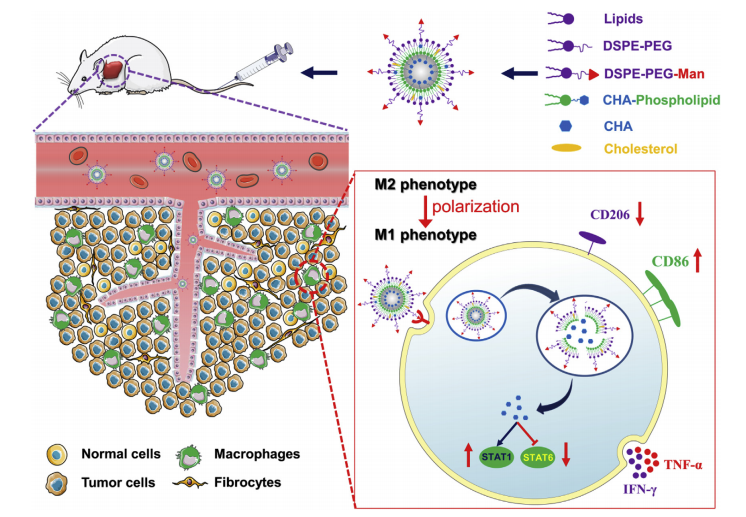 CHA封裝的Man-PEG-Lipo示意圖,該脂質體通過主動靶向表達甘露糖受體的TAMs增強腫瘤積聚,并促進TAMs的極化用于癌癥免疫治療
CHA封裝的Man-PEG-Lipo示意圖,該脂質體通過主動靶向表達甘露糖受體的TAMs增強腫瘤積聚,并促進TAMs的極化用于癌癥免疫治療
研究背景
1、膠質母細胞瘤(GBM)是最具侵襲性和常見的惡性原發性腦腫瘤,盡管經過積極治療,預后仍然不佳。
2、腫瘤微環境在促進GBM的生長和進展中起關鍵作用,TAMs作為腫瘤微環境中的主要免疫細胞群體,能夠促進腫瘤生長、血管生成、進展、轉移和免疫抑制。
3、現有研究表明,TAMs通常表現出免疫抑制的M2表型,促進腫瘤進展和轉移,因此將TAMs作為癌癥免疫治療的靶點具有潛在價值。綠原酸(CHA)是一種強效的免疫調節劑,能夠促進TAMs從M2表型向M1表型極化,但其在臨床應用中存在體內快速清除和腫瘤積累低的問題。
研究方法
1、制備了甘露糖修飾的脂質體(Man-PEG-Lipo)用于靶向遞送CHA。
2、通過溶劑蒸發法制備了CHA-磷脂復合物,并使用薄膜水合法制備了脂質體。
3、采用動態光散射(DLS)方法測量脂質體的平均粒徑和粒徑分布,使用透射電子顯微鏡(TEM)觀察脂質體的形態。
4、通過Turbiscan穩定性指數評估脂質體在PBS和含10% FBS的培養基中的物理穩定性。
使用CCK-8試劑盒評估脂質體在RAW264.7巨噬細胞和M2型BMDMs中的體外細胞毒性。
5、通過流式細胞術評估不同脂質體的體外細胞攝取情況,并使用免疫熒光和定量實時PCR分析M2型巨噬細胞的極化能力。
實驗設計
1、在體外實驗中,評估了Man-PEG-Lipo對M2型巨噬細胞的極化能力和細胞毒性。結果表明,Man-PEG-Lipo顯著抑制了M2型巨噬細胞的極化,并且對細胞無明顯毒性。
2、在體內實驗中,建立了G422膠質瘤小鼠模型,評估了Man-PEG-Lipo的抗腫瘤效果和安全性。通過體內成像和體外熒光成像評估了脂質體的組織分布,結果顯示Man-PEG-Lipo在腫瘤部位的熒光強度顯著高于其他組。
3、進一步分析了Man-PEG-Lipo在體內的極化能力,通過流式細胞術和免疫熒光分析腫瘤和脾臟組織中M1/M2亞型巨噬細胞的比例,結果顯示Man-PEG-Lipo顯著增加了M1型巨噬細胞的比例,減少了M2型巨噬細胞的比例。
結果與分析
1、Man-PEG-Lipo在體內外均表現出良好的穩定性和靶向能力,能夠有效地將CHA遞送到TAMs。
2、Man-PEG-Lipo顯著促進了TAMs從M2型向M1型的極化,抑制了G422膠質瘤的生長。
3、在體內實驗中,Man-PEG-Lipo組的腫瘤生長抑制率(TGI%)顯著高于游離CHA和其他脂質體組,最高可達60.3%。
總體結論
1、研究表明,CHA-封裝的甘露糖修飾脂質體能夠有效靶向TAMs,促進其從M2型向M1型極化,從而抑制膠質母細胞瘤的生長。
2、這種方法具有潛在的系統毒性低的優點,為GBM的TAMs靶向癌癥免疫治療提供了一種新的策略。
這篇文章展示了甘露糖修飾脂質體在提高CHA的免疫治療效果方面的潛力,具有重要的臨床應用前景。

