
ACAT1 Induces the Differentiation of Glioblastoma Cells by Rewiring Choline Metabolism
這篇論文研究了乙酰輔酶A乙酰轉移酶1(ACAT1)通過重塑膽堿代謝來誘導膠質母細胞瘤(GBM)細胞分化的機制。
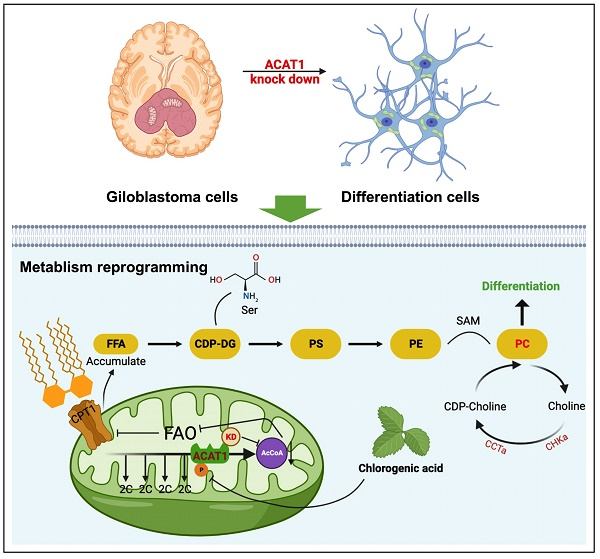 綠原酸抑制ACAT1的磷酸化,發揮抗腫瘤作用機制圖
綠原酸抑制ACAT1的磷酸化,發揮抗腫瘤作用機制圖
研究背景
1、膠質母細胞瘤(GBM)是最具侵襲性的膠質瘤類型,標準治療包括手術、放療和化療,但長期生存率仍然很低。
2、腫瘤細胞的異常分化是惡性腫瘤的一個標志,誘導癌細胞分化作為一種低毒性的治療策略在血液系統惡性腫瘤中顯示出潛力,但在實體瘤中的應用尚未明確。
3、現有研究表明,ACAT1在調節脂肪酸氧化和酮體生成中起重要作用,但其在大腦腫瘤中的作用尚不清楚。
研究方法
1、使用GEPIA工具分析ACAT1在膠質瘤患者中的高表達情況。
2、通過基因敲除技術生成ACAT1敲低(ACAT1 KD)的U87 MG和U251 MG細胞系,并通過免疫印跡和qPCR驗證敲低效果。
3、使用多模態結構光超分辨率顯微鏡(multi-SIM)和透射電子顯微鏡觀察線粒體結構和功能的變化。
4、通過代謝組學分析和質譜分析研究ACAT1 KD對代謝途徑的影響。
5、使用綠原酸(CHA)處理GBM細胞和動物模型,評估其對腫瘤生長和分化的影響。
實驗設計
1、ACAT1 KD顯著抑制了GBM細胞的增殖和遷移能力,并改變了細胞形態。
2、ACAT1 KD導致線粒體結構和功能的變化,包括線粒體面積和周長的增加,以及氧耗率的顯著提高。
3、代謝組學分析顯示,ACAT1 KD激活了膽堿代謝途徑,增加了磷脂酰膽堿(PC)的水平。
4、在體外和體內實驗中,補充PC或激活膽堿代謝途徑均促進了GBM細胞的分化。
5、CHA通過抑制ACAT1的磷酸化,顯著延緩了GBM細胞的增殖,并誘導其分化。
結果與分析
1、ACAT1 KD顯著抑制了GBM細胞的增殖和遷移能力,U87 MG和U251 MG細胞的增殖率分別下降了約50%和40%。
2、ACAT1 KD導致線粒體結構和功能的變化,線粒體面積增加了約30%,氧耗率顯著提高了約50%。
3、代謝組學分析顯示,ACAT1 KD激活了膽堿代謝途徑,PC水平顯著增加了約60%。
4、CHA處理顯著延緩了GBM細胞的增殖,U87 MG細胞的增殖率下降了約60%,并顯著增加了GFAP的表達。
總體結論
1、ACAT1通過調節脂肪酸氧化和膽堿代謝途徑來控制GBM細胞的分化和生長。
2、CHA作為一種天然小分子化合物,通過抑制ACAT1的磷酸化,能夠有效誘導GBM細胞的分化,具有作為膠質瘤治療藥物的潛力。
這篇論文揭示了ACAT1在GBM細胞分化中的關鍵作用,并提出了CHA作為潛在治療藥物的可行性。

